-
홈 -> 면역세포치료신약은 어떻게 개발되고 승인되는가고동탄(bourree@kakao.com) 기자 입력 2021년 02월 15일 11:02분5,953 읽음
- 최근 코로나19 등의 영향으로 신약개발에 대한 관심이 고조되고 있으며, 의료선진국 미국에서 신약이 어떻게 승인되는지에 대한 궁금증도 증가하고 있다. 미국바이오협회가 2006년부터 2015년까지 1103개 회사의 7455개 임상 프로젝트 성공률을 조사한 결과 신약 개발의 가장 첫 단계인 신약후보 물질 선정을 위해 ‘5,000:1~10,000:1’의 경쟁을 거친다. 이후 임상 1상에 진입한 신약후보 물질이 제대로 된 신약으로 최종 출시될 가능성은 9.6%다. 이후 신약 허가신청(NDA) 또는 생물의약품 시판 허가신청(BLA) 과정을 통해 FDA의 심사를 받게 된다.
신약개발 과정은 ① 신약 후보 물질을 도출하기 위한 탐색, ② 전임상 시험(Pre-Clinical Trial), ③ 임상시험허가신청(IND), ④ 임상시험(Clinical Trial), ⑤ 신약허가신청(NDA) 또는 생물의약품 시판 허가신청(BLA), ⑥ 시판, 시판후 안전성조사(Post-Market Surveillance) 등의 과정을 거친다.
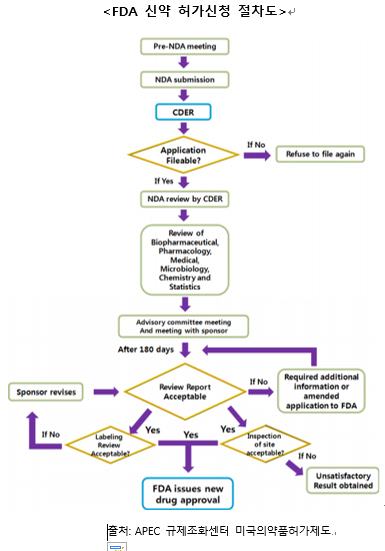
특히 임상시험은 제 1상(임상약리시험), 제 2상(치료적 탐색 임상시험), 제 3상(치료적 확증 임상시험), 제 4상(치료적 사용 임상시험)으로 세분화된다.
제 1상(PhaseⅠ) 임상시험은 소수의 건강한 지원자를 대상으로 하며 대상시험 질병의 위험도가 높은 경우 환자를 대상으로 수행하기도 한다(항암제, HIV 치료제등). 시험약의 Tolerance와 PK/PD 상의 특성을 확인하기 위한 시험이며 치료적인 목적을 갖는 시험이 아니다. 인간을 대상으로 하는 첫 단계의 시험이다(FIH or FTH: First In Human Trial).
제 2상(PhaseⅡ) 임상시험은 환자에 있어서 시험약의 유효성과 안전성을 평가하여 신약으로서의 가능성과 최적 용량, 용법을 결정하고 치료효과를 탐색하기 위한 시험이다. 시험하고자 하는 의약품이 적용될 대상질환 환자를 대상으로 수행된다(First in Patient Study). 또한 제 2상 임상시험은 전기 제2상 (Phase Ⅱa, Pilot Study)과 후기 제2상 (Phase Ⅱb, Pivotal Study)으로 구분된다. 전기 제2상 임상시험은 약효 확인, 작용 시간 및 유효 용량을 결정한다. 허가의 핵심이 되는 단계(Phase Ⅱb, Phase Ⅲ)가 아니며 효과의 증거를 찾는 것이 목적이기 때문에 반드시 허가 기관이 인정하는 변수를 사용하지 않아도 된다. 설계측면에서도 여러 가지 디자인 사용이 가능하며, 피험자 수도 통계적 검정력에 의해 결정한다.
후기 제 2상 (Phase Ⅱb, Pivotal Study) 임상시험은 약효 입증, 용량-반응양상 검토, 최적의 용량 및 용법 결정한다. 제 3상(Phase Ⅲ) 임상시험과 함께 허가의 핵심이 되는 단계이기 때문에 변수는 허가기관에서 인정하는 검증된 것을 사용해야 한다. 임상시험디자인은 일반적으로 평행군 시험으로 설계되며, 환자 수는 통계적 검정을 통해 결정된다.
제 3상(Phase Ⅲ) 임상시험은 가장 규모가 큰 임상시험으로, 유효성에 대한 추가 정보 및 확증적 자료를 확보하는 시험이다. 다수의 환자에 있어서 시험약의 안전성과 유효성을 대조약과 비교, 검토하여 유효성을 확인하고 시판시의 Label을 확정하기 위한 단계이다. 피험자 수가 많기 때문에 다국가, 다기관 연구로 수행되는 경우가 많다.
제 4상(Phase Ⅳ) 임상시험은 시판 허가승인 후에 시행되는 임상연구로 특수 약리작용 검색, 새로운 적응증 탐색 또는 시판 전 임상시험에서 검토되지 못한 특수 환자군에 대한 임상시험을 위해 시행된다.
이러한 모든 과정을 실패 없이 성공해야 비로소 새로운 약이 사장에 등장할 수 있기 때문에 신약개발 과정에 오랜 시간과 많은 비용이 필수적이다.월간암(癌) 인터넷뉴스
추천 컨텐츠
 암을 치료하는 현대적인 방법 5가지
암을 치료하는 현대적인 방법 5가지과거에 비해서 암을 치료하는 방법이 많아졌습니다. 얼마 전까지만 해도 수술이나 항암치료 그리고 방사선치료가 전부라고 생각되던 시절이 있었지만, 의학이 발전하면서 치료 방법 또한 다양해졌습니다. 최근 우리나라도 중입자 치료기가 들어오면서 암을 치료하는 방법이 하나 더 추가되었습니다. 중입...
 깨끗한 혈액 만들기 위해 생각할 것, 6가지
깨끗한 혈액 만들기 위해 생각할 것, 6가지필요 이상으로 많은 음식을 먹는다 현대인의 생활을 고려해 볼 때 육체노동자가 아니라면 세끼를 모두 챙겨 먹는 자체가 과식이라고 할 수 있다. 인류가 살아온 300만 년 중 299만 9950년이 공복과 기아의 역사였는데 현대 들어서 아침, 점심, 저녁을 습관적으로 음식을 섭취한다. 게다...
 [에세이] 사유(思惟)를 만나다
[에세이] 사유(思惟)를 만나다글: 김철우(수필가) 가벼운 옷을 골랐다. 늘 들고 다니던 가방을 놓고, 가장 편한 신발을 신었다. 지난밤의 떨림과는 무색하게 준비는 간단했다. 현관문을 나서려니 다시 가벼운 긴장감이 몰려왔다. 얼마나 보고 싶었던 전시였던가. 연극 무대의 첫 막이 열리기 전. 그 특유의 무대 ...
 나를 위로하는 방법, 한 가지
나를 위로하는 방법, 한 가지우리 주위에 대부분의 사람들은 하루하루를 열심히 살아갑니다. 그러나 범죄를 저질러 교도소에서 지내는 사람들도 있습니다. 밝혀지지 않았을 뿐 죄를 저지른 채 살아가는 사람도 있을 것입니다. 우리나라 통계청 자료에서는 전체 인구의 3% 정도가 범죄를 저지르며 교도소를 간다고 합니다. 즉 1...

- 월간암 - 정기구독신청
1년 5만원 정기구독료를 납부하시면 매월 집에서 편하게 월간암을 접할 수 있습니다. - 고려인삼공사 - 문의전화: 02-862-3992
시베리아 자작나무에서 채취 관리, 러시아 정부가 인증한 고려인삼공사 최상급 차가버섯 추출분말








